
-
 Italia pronta a cooperare con la nuova Space Agency di Singapore
Italia pronta a cooperare con la nuova Space Agency di Singapore
-
Odessa sotto attacco, danni a edifici residenziali e pubblici

-
 Netflix difende in Congresso la sua acquisizione di Warner
Netflix difende in Congresso la sua acquisizione di Warner
-
Calcio: Inghilterra, l'Arsenal batte il Chelsea e va in finale di Coppa di Lega

-
 Il Milan vince 3-0 a Bologna e accorcia sull'Inter
Il Milan vince 3-0 a Bologna e accorcia sull'Inter
-
Venezuela, studenti in piazza per l'amnistia e la libertà dei prigionieri politici

-
 La figlia di Raul Castro, 'con l'imperialismo niente negoziati'
La figlia di Raul Castro, 'con l'imperialismo niente negoziati'
-
Ciclismo: Europei pista, bronzo di Favero nell'inseguimento individuale

-
 Cucinelli, 'in Italia i migliori manifatturieri, ma gli operai vanno pagati di più'
Cucinelli, 'in Italia i migliori manifatturieri, ma gli operai vanno pagati di più'
-
Al Arabiya, Saif Gheddafi ucciso durante scontri tra milizie a Zintan

-
 Media libici, morto Saif al-Islam Gheddafi, uno dei figli del rais
Media libici, morto Saif al-Islam Gheddafi, uno dei figli del rais
-
Giorno memoria rom e sinti, emoziona concerto Spinelli alla Carnegie Hall

-
 Un mistero medico di 12mila anni fa risolto grazie al Dna antico
Un mistero medico di 12mila anni fa risolto grazie al Dna antico
-
F1: Daily Mail, Hamilton si separa dal suo manager Hynes

-
 Ondata di freddo a Cuba, raggiunti gli zero gradi
Ondata di freddo a Cuba, raggiunti gli zero gradi
-
Pieraccioni, '30 anni da Il Ciclone, mi sembra frazione di secondo'

-
 Agenzia entrate, adempimento collaborativo apre alle piccole e medie imprese
Agenzia entrate, adempimento collaborativo apre alle piccole e medie imprese
-
Io+Te, Paolillo e Pantano in una storia d'amore intensa e contemporanea

-
 Scoperte le onde cerebrali che determinano la percezione del sé corporeo
Scoperte le onde cerebrali che determinano la percezione del sé corporeo
-
Cinema, #siamoaititolidicoda aderisce all'Usb

-
 Sanremo dalla A alla Z, ci sono anche Totò e il Califfo
Sanremo dalla A alla Z, ci sono anche Totò e il Califfo
-
Borsa: Milano chiude positiva con l'Europa debole, scivola Nexi

-
 Il prezzo del gas chiude in calo a 32,86 euro al megawattora
Il prezzo del gas chiude in calo a 32,86 euro al megawattora
-
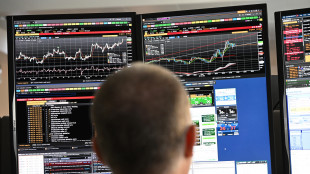
Lo spread tra Btp e Bund chiude in calo a 60 punti
-
 Cam Sugar amplia il suo catalogo con l'acquisizione di Cecchi Gori Music
Cam Sugar amplia il suo catalogo con l'acquisizione di Cecchi Gori Music
-
Inail, nel 2025 aumentano infortuni studenti a scuola, 8 i morti

-
 F1: la Williams svela online la livrea della monoposto 2026
F1: la Williams svela online la livrea della monoposto 2026
-
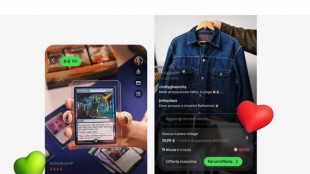
eBay sfida TikTok e lancia in Italia lo shopping in tempo reale
-
 Le cellule del naso uniscono le forze contro il virus del raffreddore
Le cellule del naso uniscono le forze contro il virus del raffreddore
-
Milano Cortina:'non sono competitivo', il norvegese Kilde rinuncia ai Giochi

-
 E' caro-Fido, 149 euro l'aumento medio per mantenere cani e gatti
E' caro-Fido, 149 euro l'aumento medio per mantenere cani e gatti
-
Mandelson si dimette da lord per lo scandalo Epstein

-
 Robbie Williams cerca di chiamare i fan anni '90 ma il numero non funziona
Robbie Williams cerca di chiamare i fan anni '90 ma il numero non funziona
-
Rob, dopo X Factor il nuovo singolo La mia storia

-
 Ha-Chan, Shake Your Booty!, ballare con il lutto e il desiderio
Ha-Chan, Shake Your Booty!, ballare con il lutto e il desiderio
-
Kings League annuncia un round di investimento da 63 milioni di dollari

-
 Francesco Renga, in autunno in tour nei teatri
Francesco Renga, in autunno in tour nei teatri
-
Agens, Fand e Fish insieme per abbattere le barriere del trasporto pubblico

-
 Luna, Rinviato a marzo il lancio di Artemis II con 4 astronauti
Luna, Rinviato a marzo il lancio di Artemis II con 4 astronauti
-
LDA e Aka 7even, il 6 marzo il primo album insieme Poesie clandestine

-
 Presentato al Tevere Remo il libro 'Diritto dello sport'
Presentato al Tevere Remo il libro 'Diritto dello sport'
-
Arera, a gennaio +10,5% in bolletta del gas per i vulnerabili

-
 Macron, 'si lavora alla ripresa del dialogo con Putin'
Macron, 'si lavora alla ripresa del dialogo con Putin'
-
Alis, dal 10 al 13 marzo alla fiera di Verona torna LetExpo

-
 Jovanotti nelle stanze del Quirinale dopo la nomina a commendatore
Jovanotti nelle stanze del Quirinale dopo la nomina a commendatore
-
PayPal nomina un nuovo Ceo, risultati trimestre deludono

-
 Metheny, Miller, Krall e Bollani nell'estate jazz di Musica per Roma
Metheny, Miller, Krall e Bollani nell'estate jazz di Musica per Roma
-
Serie B: 10 giocatori squalificati per un turno

-
 Riccardo Muti dirige Macbeth al Regio di Torino
Riccardo Muti dirige Macbeth al Regio di Torino
-
Musk unisce SpaceX e xAI, nasce colosso da 1.250 miliardi


Come il velcro, ecco come l'antibiotico attacca il batterio
Piccoli uncini adesivi, osservati per prima volta al microscopio
Aderisce ai batteri come il velcro, con tanti piccoli 'uncini' da cui è impossibile liberarsi: è il meccanismo d'azione della plectasina di cui si è osservato per la prima volta il comportamento in dettaglio e che potrebbe aprire nuove soluzioni per sviluppare gli antibiotici del futuro. A scoprire come riesce ad agganciarsi ai batteri bersaglio è stato il gruppo di ricerca guidato Markus Weingarth e dal biochimico Eefjan Breukink dell'Università di Utrecht in un lavoro pubblicato su Nature Microbiology. La plectasina è un antibiotico derivato da un fungo, Pseudoplectania nigrella, noto da una ventina di anni ed utilizzato per contrastare in particolare alcuni tipi di batteri resistenti ai trattamenti tradizionali. Per comprenderne meglio il meccanismo di azione i ricercatori lo hanno osservato usando alcune delle tecniche più avanzate di microscopia scoprendo che a differenza di quanto ipotizzato finora la plectasina non si lega alle cellule utilizzando una sorta di 'chiave' per agganciarsi alla parete esterna dei batteri bensì una sorta nastro di velcro. La plectasina, infatti, forma come tanti piccoli uncini che si agganciano a strutture simili ad anelli presenti sulla superficie batterica, un meccanismo che ricorda molto da vicino il velcro. Una tecnica che impedisce alla cellula di liberarsi dell'antibiotico e che, suggeriscono i ricercatori, potrebbe essere comune in gran parte degli antibiotici: "un meccanismo che era rimasto finora sconosciuto", ha detto Weingarth. "Il nostro studio - aggiunge - colma un'importante lacuna di conoscenze che potrebbe avere ampie implicazioni per la progettazione di farmaci migliori per combattere la crescente minaccia della resistenza antimicrobica".
S.Abdullah--SF-PST
